Segunda Ley de la Termodinámica
La Segunda Ley de la Termodinámica establece que la entropía total de un sistema aislado siempre tiende a aumentar con el tiempo o, en el mejor de los casos, se mantiene constante en procesos reversibles. En términos más simples, la energía siempre fluye de una forma más ordenada a una más desordenada, y no es posible que toda la energía en un sistema se convierta en trabajo útil sin pérdidas.
Esta ley tiene diversas formulaciones, siendo las más importantes:
- Clausius: «El calor no puede transferirse espontáneamente de un cuerpo frío a un cuerpo caliente sin la intervención de una fuente externa de energía.»
- Kelvin-Planck: «Es imposible construir un motor térmico que opere en un ciclo y convierta todo el calor absorbido en trabajo sin pérdidas.»
Ejemplos de Aplicación de la Segunda Ley de la Termodinámica
1. Motores de combustión interna
Los motores térmicos, como los de gasolina y diésel, funcionan mediante la conversión de energía química en trabajo mecánico. Sin embargo, una parte de la energía se disipa en forma de calor a través del escape y la fricción, lo que demuestra que no es posible convertir toda la energía en trabajo útil.
2. Refrigeradores y aires acondicionados
Estos dispositivos transfieren calor de un ambiente frío a otro más caliente utilizando energía externa (electricidad). Esto cumple con la formulación de Clausius, ya que el calor no puede fluir de un cuerpo frío a uno caliente sin la intervención de un sistema de refrigeración.
3. Generación de electricidad en centrales térmicas
Las centrales eléctricas de carbón, gas o nucleares convierten calor en electricidad. Sin embargo, no pueden convertir todo el calor en electricidad útil, ya que parte de la energía se pierde en forma de calor residual, generalmente disipado en torres de enfriamiento.
4. Dilución de una gota de tinta en agua
Si se coloca una gota de tinta en un vaso con agua, se dispersa gradualmente hasta que el sistema alcanza un estado de máxima entropía, donde la tinta se distribuye de manera uniforme. Este proceso es irreversible y ejemplifica el aumento de entropía en sistemas naturales.
5. Desgaste y fricción en máquinas
Cualquier máquina sufre desgaste debido a la fricción entre sus componentes. Parte de la energía mecánica se transforma en calor y se disipa en el ambiente, lo que confirma que no se puede convertir completamente la energía mecánica en trabajo sin pérdidas.
Problema resuelto
La Segunda Ley de la Termodinámica rige la dirección de los procesos naturales y explica por qué ciertos procesos son irreversibles. Se aplica en campos como la ingeniería, la climatización, la generación de energía y muchos otros sistemas físicos y químicos.
Para mostrar una aplicación de la Segunda Ley de la Termodinámica veamos el siguiente ejemplo.
La eficiencia de un motor de combustión interna es 0.81. Calcula la cantidad de calor absorbida por la fuente caliente en cada ciclo si éste realiza un trabajo de 34,000 cal. Incluir imágenes de la situación física y diagramas de termodinámicos así como el procedimiento de solución paso por paso.
Para resolver este problema, utilizamos la ecuación de eficiencia térmica de un motor de combustión interna. Es decir, la Segunda Ley de la Termodinámica expresada de la siguiente manera:
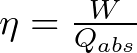
donde:
- es la eficiencia del motor (0.81 o 81%)
- W es el trabajo realizado por ciclo (34,000 cal)
- Qabs es la cantidad de calor absorbida por la fuente caliente, que es lo que queremos encontrar.

al despejar el calor absorbido,
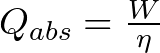
sustituyendo los valores,
![]()
![]()
Esto significa que el motor absorbe aproximadamente 41,975.31 calorías de la fuente caliente en cada ciclo.